Con elementos sencillos se pueden lograr experimentos maravillosos y cautivantes. Mientras más complejos los materiales, más complejos los experimentos, pero que aún así asombran a chicos y grandes.
El doctor en Química, Ariel Maratta, comparte 4 experimentos un poco más complejos que los anteriores. Cabe recordar que, a diferencia de los otros, debe realizarlos un adulto responsable por el nivel de dificultad y los materiales a trabajar, pero, aun así, se pueden disfrutar y aprender en familia.
Bomba de termita
Las reacciones de termita son rédox muy exotérmicas, generan elevadas temperaturas y producen efectos pirotécnicos espectaculares.
INFORMACIÓN IMPORTANTE: El doctor Maratta recomienda utilizar pequeñas cantidades de reactivos para evitar riesgos. Esta reacción puede expulsar trozos de metal fundidos, por lo que se debería llevar a cabo en el exterior y con gafas protectoras.

Materiales:
Óxido de hierro en polvo (una cucharada)
Aluminio en polvo (una cucharada)
Una luz de bengala, conocida como “estrellita” (las de pirotecnia)
Un recipiente con arena (se recomienda que sea de cerámica, tipo cuenco, de unos 20 cm de diámetro)
Papel de filtro (pueden ser los usados en cafeteras)
Recipiente para mezclar (un vaso o frasco)
Un palito de helado para mezclar
Encendedor
Gafas de seguridad
Procedimiento:
Primero, preparar la mezcla de “termita” en el recipiente, agregando una cuchara de óxido de hierro y una de polvo de aluminio, mezclarlas bien. Hay que tener en cuenta que es importante que estos dos reactivos estén lo más pulverizados posibles y bien secos (se pueden secar en un horno por separado antes de mezclarlos).
En el cuenco con arena, colocar en el medio un cono de papel de filtro, lo suficientemente grande para que puedas volcar la mezcla. Corroborar que este semi enterrado y bien colocado.
Una vez que vertiste la mezcla en el cono, colocar la bengala como “mecha” en el medio. Es hora de encender la mecha. Similar a cuando se enciende cualquier pirotecnia, hay que tomar una distancia prudente de 5 metros y observar con cuidado, utilizando las gafas de seguridad.
La mezcla se enciende inmediatamente y emite chispas. Cuando termina la reacción, la mezcla se convierte en una masa incandescente, con una temperatura de 2000 °С, por lo que debes esperar hasta que se enfríe.
En el interior del recipiente vas a encontrar pepitas de hierro cubiertas con arena fundida. Si quieres apreciarlas mejor, fragmenta el sólido con ayuda de un martillo.
Explicación:
La mezcla de polvo de aluminio y óxido de hierro se la conoce como “termita”. Esta es una mezcla combustible oxidante, por la que el aluminio es oxidado por otro metal, generalmente óxidos de hierro, pero se puede utilizar también dióxido de manganeso y óxido de cobre.
El aluminio tiene un punto de fusión de 660 °C, por lo que es fácil fundir el metal, pero se requiere para iniciar la combustión de la termita esa temperatura, lo cual es difícil con métodos pirotécnicos convencionales. Debido a esto, implementamos la bengala estrellita, dado que por sí misma es una mezcla de un combustible metálico y un oxidante que se amalgaman con un retardante llamado dextrina. Su punta incandescente alcanza temperaturas entre 1000 y 1600 °C, lo cual es suficiente para iniciar la reacción de termita.
Luego, al fundirse tan fácil el aluminio, la reacción ocurre en fase líquida. La reacción, que es extremadamente exotérmica, alcanza una temperatura de 2500 °C, muy próximo al punto de ebullición del aluminio. Durante la reacción química, el aluminio reduce el óxido de hierro a hierro metálico y por sí mismo se oxida a óxido de aluminio. A alta temperatura, el óxido de aluminio se hornea junto con la arena, formando una cáscara similar al vidrio. Como la reacción termita tiene su propia fuente de oxígeno, no necesita fuente de aire alguna; puede reaccionar hasta debajo del agua.
La termita se utiliza para soldar rieles y fundir objetos grandes, por ejemplo.
Lámpara química
Logra una cautivante lámpara a partir de una reacción de óxido reducción. Debido a los gases que se desprenden, debe hacerse en un área ventilada, ya que puede ser tóxico.
INFORMACIÓN IMPORTANTE: Es recomendable usar protección para los ojos y tener cuidado porque el recipiente se calentará mucho durante la reacción.

Materiales:
Acetona (es recomendable que sea pura, pero también sirve usar quitaesmalte)
Alambre de cobre
Palito de helado (puede ser un lápiz también)
Recipiente de vidrio transparente (puede ser un frasco o un vaso)
Encendedor
Procedimiento:
Colocar unos 30ml de acetona en el recipiente de vidrio. Aparte, enrollar el alambre de cobre en espiral o de cualquier otra forma que te guste, procurando que entre por la boca del frasco, sin olvidar dejar un poco de alambre extra que luego enrollarás en el palito de helado, de modo que el palito quede apoyado en la boca del recipiente y tu figura de alambre de cobre quede colgando a un centímetro aproximadamente de la acetona.
Es recomendable hacer este experimento en un lugar oscuro para apreciar mejor el fenómeno.
Con el encendedor calentar la figura de cobre hasta que tome color rojo (para no quemarte, puedes ayudarte con algún cartón o similar que mantenga una llama cerca del alambre). Con cuidado, ubicar el alambre de cobre en el frasco. Recuerda que no tiene que tocar la superficie de la acetona.
Es hora de observar tu experimento. Podrás ver como la figura de alambre comienza a brillar cada vez más. Se puede mejorar el experimento colocando papel de servilleta alrededor del vaso, estando en contacto con la acetona.
Explicación:
La acetona es un líquido muy volátil. Su vapor llena rápidamente el espacio de aire en el recipiente que la contiene. Cuando el alambre de cobre incandescente se baja al vapor de acetona, comienza una reacción en la superficie del metal, que es catalizada por el cobre.
Al calentar el cobre al rojo vivo, éste se oxida fácilmente, es decir, reacciona con el oxígeno del aire formando óxido de cobre. Cuando el óxido de cobre entra en contacto con la acetona, cataliza rápidamente la reacción de combustión de la acetona, formando acetaldehído, dióxido de carbono y agua, a la vez que el óxido de cobre se transforma en cobre. La reacción es tan exotérmica que mantiene al cobre al rojo vivo.
De este modo, en la superficie del cobre se produce una curiosa alternancia entre un ennegrecimiento por oxidación y un brillo muy destacado por reducción, pudiéndose observar como “oleadas” del color típico del cobre elemental.
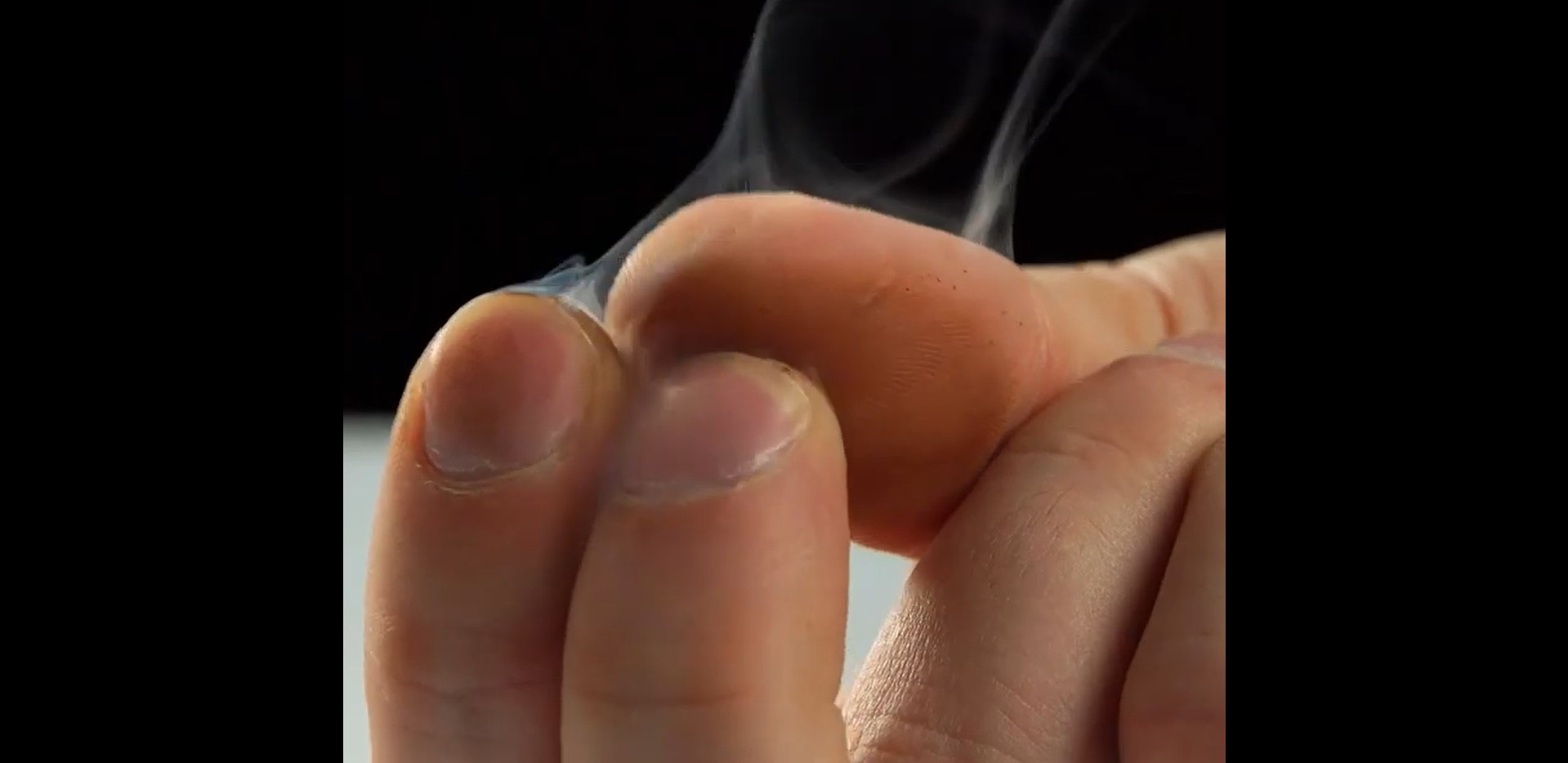
Dedos Humeantes
Este simple y entretenido experimento es digno de un acto de magia.
INFORMACIÓN IMPORTANTE: Trabajar en un área bien ventilada y no realizar este experimento con frecuencia, ya que los compuestos que se generan pueden ser dañinos para su salud.
Materiales:
Raspadores de caja de fósforos (hay que juntar los de 5 cajas por lo menos)
Bol o cuenco de porcelana que no sea poroso, que esté esmaltado)
Encendedor
Procedimiento:
Retirar los raspadores de las cajitas de fósforos y colocarlos todos en el cuenco de porcelana. Con el encendedor, quemarlos completamente, eliminar los restos que no se quemen y las cenizas.
Vas a observar un residuo pegado en la base del cuenco, de consistencia similar al alquitrán, bien espeso.
Para completar la experiencia, retirar con tus dedos el alquitrán y luego frotarlos durante unos segundos. Listo, ¡tendrás tus dedos humeantes!
Explicación:
Las tiritas para raspar contienen fósforo rojo. A medida que se queman, se forma un alquitrán espeso que contiene un óxido de fósforo, el cual queda depositado en el cuenco de porcelana. Este óxido de fósforo absorbe rápidamente el agua del aire para formar ácido fosfórico.
Cuando se aplica fricción con los dedos, el ácido fosfórico se evapora parcialmente, creando un efecto de "humo".
La botella que implosiona
Es común ver una experiencia donde se utiliza una lata de aluminio, la cual se calienta y luego se coloca en agua fría para ver como esta se aplasta. Este experimento es similar, pero en este caso usaremos una reacción química que hará implosionar una botella de plástico.

Materiales:
Bicarbonato de sodio (4 cucharadas)
Vinagre (100 ml)
Solución de hidróxido de sodio (se puede usar limpia cañerías que contenga hidróxido de sodio, soda caustica, etc.)
Botella de plástico con tapa de un litro
Palo para brochette (o cualquier palito fino y largo)
Encendedor
Procedimiento:
Agregar en la botella 4 cucharadas de bicarbonato de sodio y la totalidad del vinagre.
Una vez que se genere esta tumultuosa reacción química, que produce una gran cantidad de dióxido de carbono, esperar a que finalice. Se puede ayudar agitando un poco la botella, sin colocar aun la tapa.
El siguiente paso es asegurarte de que la botella está completamente llena de dióxido de carbono, lo cual lo vas a hacer insertando la punta del palito de madera encendido en la botella. Si la llamita se apaga, la botella esta lista para el siguiente paso, en caso contrario, podes agregar más vinagre y bicarbonato de sodio.
Finalmente, colocar en la botella un poco de limpia cañerías a base de hidróxido de sodio. Automáticamente, enroscar la tapa a la botella y agitar vigorosamente.
Momento de observar el fenómeno. La mezcla del interior se calienta notablemente y la botella se contrae como si implosionara. No olvides no tocar la botella, lo importante es la observación del fenómeno que se produce.
Explicación:
El bicarbonato de sodio y el vinagre reaccionan para formar acetato de sodio, agua y dióxido de carbono. El dióxido de carbono reemplaza gran parte del aire de la botella, que ha sido expulsado de la misma. Esto se verifica al introducir el palito encendido.
El limpiador de cañerías generalmente contiene hidróxido de sodio que, cuando se introduce en la botella, interactúa con el dióxido de carbono, liberando una cantidad significativa de calor y formando bicarbonato de sodio. Esta reacción genera que la cantidad de gas en la botella disminuya y la botella es comprimida por efecto de la presión externa.
Colaboración:
Ariel Maratta. Doctor en Química de la UNSL. Mg. en Química Analítica de la UNSL y profesor de Química de la UNSJ.
